Tube à fusée
Un tube à essai décolle comme une fusée !

Réactifs
Sécurité
- Portez des gants et des lunettes de protection.
- Réalisez l'expérience sur le plateau.
- Éviter tout contact des produits chimiques avec les yeux ou la bouche.
- Éloigner les jeunes enfants, les animaux et les personnes sans équipement de protection des yeux de la zone où sont réalisées les expériences.
- Ranger ce coffret d’expériences hors de portée des enfants de moins de 10 ans.
- Nettoyer la totalité du matériel après utilisation.
- S’assurer que tous les récipients sont hermétiquement fermés et convenablement stockés après utilisation.
- S’assurer que tous les récipients vides sont correctement éliminés.
- Ne pas utiliser d’autre matériel que celui fourni avec le coffret ou recommandé dans la notice d’utilisation.
- Ne pas remettre les denrées alimentaires dans leur récipient d’origine. Les jeter immédiatement.
- En cas de contact avec les yeux : laver abondamment à l’eau en maintenant les yeux ouverts si nécessaire. Consulter immédiatement un médecin.
- En cas d’ingestion : rincer la bouche abondamment avec de l’eau, boire de l’eau fraîche. Ne pas faire vomir. Consulter immédiatement un médecin.
- En cas d’inhalation : transporter la personne à l’extérieur.
- En cas de contact avec la peau et de brûlures : laver abondamment à l’eau la zone touchée pendant au moins 10 minutes.
- En cas de doute, consulter un médecin sans délai. Emporter le produit chimique et son récipient.
- En cas de blessure, toujours consulter un médecin.
- L’utilisation incorrecte des produits chimiques peut engendrer des blessures et nuire à la santé. Réaliser uniquement les expériences décrites dans les instructions.
- Ce coffret d’expériences est à utiliser uniquement par des enfants de plus do 10 ans.
- Compte tenu de très grandes variations des capacités des enfants, même au sein d’un groupe d’âge, il convient que les adultes surveillants apprécient avec sagesse quelles sont les expériences appropriées et sans risque pour les enfants. Il convient que les instructions permettent aux adultes surveillants d’évaluer chacune des expériences afin de pouvoir déterminer son adéquation à un enfant particulier.
- Il convient que l’adulte surveillant s’entretienne des avertissements et des informations de sécurité avec l’enfant ou les enfants avant de commencer les expériences. Il convient d’accorder une attention particulière à la sécurité lors de la manipulation d’acides, d’alcalis et de liquides inflammables.
- Il convient que la zone où sont réalisées les expériences soit sans obstacle et ne soit pas située près d’une réserve de denrées alimentaires. Il convient qu’elle soit bien éclairée et aérée, et à proximité d’une adduction d’eau. Il convient d’utiliser une table solide dont la surface est résistante à la chaleur.
- Il convient d’utiliser complètement les substances contenues dans des emballages non refermables au cours d’une expérience, c’est-à-dire après l’ouverture de l’emballage.
FAQ et dépannage
En effet, ce réactif a tendance à s'agglutiner lorsqu'il est stocké. Utilisez un bâtonnet en bois ou autre pour briser les grumeaux.
Vous pouvez répéter cette expérience autant de fois que vous le souhaitez – vous avez déjà tous les ingrédients nécessaires à la maison ! Le bicarbonate de sodium NaHCO3 est du bicarbonate de soude ordinaire. Et même si vous manquez d’acide citrique dans votre cuisine, il est inutile de vous précipitez dans une épicerie : utilisez du vinaigre ordinaire plutôt que de l’eau. Versez 2 à 3 ml de vinaigre dans le tube à essai et effectuez les étapes 2 à 4.
Lorsque vous placez le tube dans le bécher, positionnez-le dans un angle de 45o.
Instructions pas à pas
La réaction se fera dans une solution aqueuse.
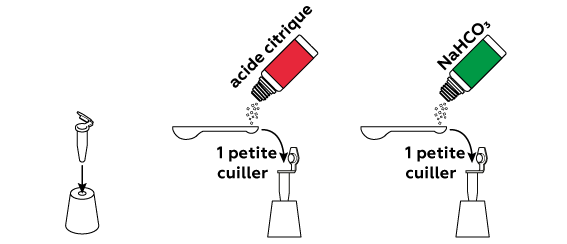
L'acide citrique sec et le bicarbonate de soude NaHCO3 ne réagissent pas entre eux. Vous pouvez donc les mélanger à l'avance.
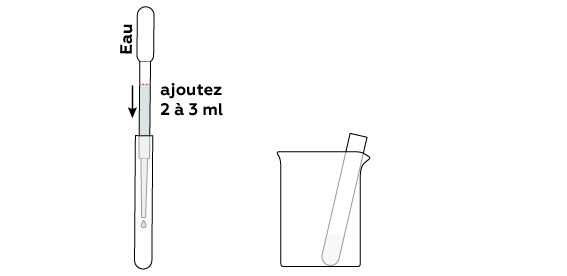
Pour réagir entre eux, les composés doivent être dissous dans l'eau.
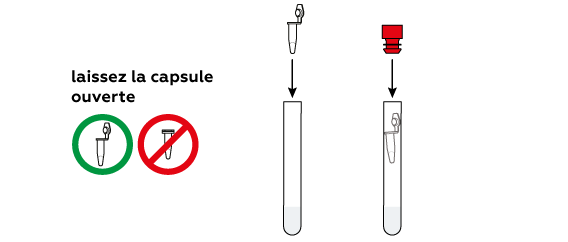
L'acide citrique sec et le bicarbonate de soude se dissolvent rapidement dans l'eau et réagissent l'un avec l'autre, produisant du CO2 . Au final, la pression à l'intérieur du tube force le tube à sortir du bouchon et à se propulser dans les airs, presque comme une véritable fusée.

Élimination des déchets
Jetez les déchets solides avec les ordures ménagères. Versez les solutions dans l'évier. Lavez à grande eau.
Description scientifique


de H3C6H5O7. Cette réaction d'échange d'ions produit de l'eau H2O




Pourquoi le tube à essai est-il propulsé dans les airs ?
Le tube à essai prend son envol à cause des gaz formés lors d'une réaction chimique. Lorsque le tube est correctement fermé avec un bouchon, le gaz s'y accumule. Une fois qu’une certaine quantité de gaz s’accumule dans le tube à essai, celui-ci jaillit et force la déconnection du bouchon. Et nous avons décollé !
Le bouchon est fixé dans le tube de telle sorte qu'une force doit être appliquée pour le retirer. Dans des circonstances normales, vous appliqueriez facilement cette force avec vos mains. Mais comment le gaz fait-il la même chose de l'intérieur ?
Initialement, le tube contient seulement de l'air. Et l'air à l'intérieur et à l'extérieur du tube est plus ou moins uniforme : il est composé d'un grand nombre de molécules, principalement de l'azote N2 et de l'oxygène O2, qui se déplacent constamment. À la température ambiante, la vitesse moyenne de ces molécules est de près de 500 mètres par seconde (1800 km/h !). C’est une très grande vitesse. À titre de comparaison, les voitures de course F1 se déplacent à une vitesse 5 fois inférieure – jusqu'à 100 mètres par seconde (360 km/h ou 224 m/h) !
En d'autres termes, les molécules d'air se déplacent assez rapidement, se heurtant entre elles et aux objets environnants. Heureusement, elles sont très petites. Nous ne ressentons donc pas ces collisions sur une base individuelle, mais nous connaissons leur résultat cumulatif : la pression. La pression, qui est généralement associée au symbole P, est une caractéristique qui décrit le nombre de ces molécules qui entrent en collision avec un objet par unité de temps et la vitesse à laquelle ces molécules se déplacent au cours de ces collisions. Même les masses de ces molécules contribuent à ce calcul, mais nous n'en tiendrons pas compte pour l'instant. Nous pourrions même dire que les molécules d'air environnantes exercent une pression sur nous et sur des objets, comme le tube.
Tandis que du gaz commence à se former et à s'accumuler à l'intérieur du tube, les conditions à l'extérieur du tube restent relativement inchangées. Après un certain temps, il y a beaucoup plus de molécules de gaz à l'intérieur du tube qui heurtent les parois et le bouchon, qu'à l'extérieur du tube. Nous disons alors qu'il y a une pression relativement élevée à l'intérieur du tube. Et à un moment donné, cette pression augmente suffisamment pour vaincre la force (appelée friction) qui maintient le bouchon en place dans le tube. Et c'est alors que le tube décolle !
Vous pouvez obtenir le même résultat sans réactions chimiques en chauffant le tube (et donc, l’air qu’il contient). Cela augmentera la vitesse des molécules de gaz et les fera entrer en collision avec les parois et le bouchon plus vigoureusement, faisant ainsi augmenter la pression.
La troisième façon de déconnecter le tube du bouchon et de le lancer consiste à abaisser la pression à l'extérieur du tube. Nous pouvons y parvenir en plaçant le tube dans une boîte à vide spéciale et en retirant l’air de la boîte. Bientôt, il y aura si peu de molécules à l'extérieur du tube frappant le bouchon et le tube de l'extérieur, que la pression à l'intérieur du tube sera en mesure de surmonter la force de friction.
Quel est le gaz que nous obtenons et comment se forme-t-il ?
C'est du dioxyde de carbone CO2. Le dioxyde de carbone se forme lorsque l’on mélange l’hydrogénocarbonate de sodium NaHCO3 et l’acide citrique.
Lorsque nous retournons le tube à essai à l'envers, l'hydrogénocarbonate de sodium NaHCO3 et l'acide citrique H_[3}C6H5O7 se dissolvent dans l'eau et commencent à interagir. Lorsqu'ils se dissolvent, les ions suivants se forment :
NaHCO3 → Na+ + HCO3–
H3C6H5O7 → 3H+ + C6H5O73–
H+ de l'acide citrique et HCO3– du carbonate réagissent pour produire de l'eau et du dioxyde de carbone gazeux :
H+ + HCO3– → H2O + CO2↑
Une telle réaction est, plutôt intuitivement (puisque les substances s'échangent littéralement des ions) connue sous le nom de réaction d'échange d'ions.
Le dioxyde de carbone s'accumule progressivement et augmente sensiblement la pression à l'intérieur du tube. Comme il n'y a pas assez de place pour l'air et le dioxyde de carbone combinés, ils commencent à pousser sur le bouchon et sur les parois du tube. À un moment donné, le bouchon ne peut plus contenir la pression : il se détache et se dépose au fond du bécher. Rien n’arrête alors le tube, qui décolle comme une fusée.
Comment le tube vole-t-il ? Les fusées volent-elles de la même manière ?
En fait, le tube vole plutôt comme un boulet de canon tiré d'un certain angle dans les airs. Les vraies fusées volent grâce à d'autres processus physiques, qui résultent de la libération d'un énorme volume de gaz chauffé par la buse de la fusée. La force motrice d’une fusée repose également sur un autre type de réaction chimique appelée réaction d’oxydo-réduction.
Comment puis-je faire voler mon tube aussi haut ou aussi loin que possible ?
Pour que le tube vole aussi haut que possible, placez-le verticalement sur son bouchon, en pointant le nez droit vers le ciel.
Pour que le tube vole le plus loin possible, placez-le dans un angle de 45o.
Pourquoi devriez-vous éviter de mélanger les réactifs et l'eau avant la dernière étape ?
Lors de la dissolution dans l'eau, l'acide citrique et l'hydrogénocarbonate de sodium réagissent immédiatement ensemble. Ce processus produit une grande quantité de dioxyde de carbone CO2, qui devrait servir de « carburant » à notre fusée. Cependant, une certaine quantité de CO2 doit d'abord s'accumuler dans le tube fermé pour que la fusée puisse voler. Si vous versez simplement tous les réactifs dans l’eau, une grande partie du CO2 en formation s’échappera avant que vous ne scelliez le tube.
Ça, c’est intéressant !
Pour voler, une fusée à réaction moderne a besoin de carburant. Normalement, lorsque nous parlons de « carburant », nous faisons référence à des substances inflammables. Mais quel type de carburant fonctionne le mieux pour les fusées ?
Les carburants pour fusées, tout d’abord, se distinguent par leurs états de matière : ils peuvent être solides, liquides ou hybrides. Chacun de ces états a ses avantages et ses inconvénients.
Le carburant le plus largement utilisé est liquide, car le carburant liquide permet une plus grande précision dans les manœuvres. Non seulement un moteur peut être allumé et éteint, mais la poussée peut être ajustée en conséquence. Cela fonctionne de la même manière qu'une voiture à essence ! De plus, le carburant liquide est relativement peu coûteux.
Cependant, dans un espace ouvert, les moteurs à combustible liquide doivent être manipulés avec beaucoup de soin. Même leur transport nécessite de la prudence. Inutile de dire qu'une fuite de carburant accidentelle à bord d'une fusée serait extrêmement dangereuse ! De plus, en apesanteur, un énorme volume de liquide peut être instable, ce qui peut déséquilibrer une fusée. Enfin, il semblerait que nous ayons déjà atteint les limites de ce qui peut être fait avec du carburant liquide. Malheureusement, il serait impossible d’envoyer un énorme et lourd vaisseau spatial pour un voyage cosmique lointain avec un carburant à base de kérosène. Un vaisseau ne serait pas capable de le remorquer dans de telles quantités. Il en va de même pour l’oxygène et l’hydrogène liquides, autrement pratiques : ils ne peuvent pas être suffisamment compressés pour être transportés en quantités suffisantes.
Les carburants solides comportent deux composants : une substance inflammable et un oxydant, qui provoque l’inflammation de la substance inflammable en question au bon moment. Les deux composants sont compressés afin d'occuper moins d'espace – et le tour est joué ! Tout est confiné, contrôlé et sécurisé ! Il y a cependant un inconvénient majeur : une fois qu'un combustible solide est allumé, il brûlera jusqu'à l'épuisement. En d’autres termes, il n’existe aucun moyen d’« allumer » et d’« éteindre » une telle fusée. Sa maniabilité est également limitée.
Le troisième type de carburant pour fusée est hybridé. À ce stade, il semblerait que ce soit la version la plus prometteuse des trois. Son avantage réside dans le fait que ses composants – un composé solide inflammable et un oxydant gazeux ou liquide – peuvent être mélangés même à bord du vaisseau. Ainsi, lorsque cela est nécessaire, le flux du composant oxydant peut être désactivé pour arrêter le moteur. De plus, les carburants hybrides sont relativement sécuritaires et fiables.
Le composant liquide dans un carburant hybride est généralement de l’oxygène comprimé O2. Au quotidien, l'oxygène gazeux sert d'oxydant lorsque nous grillons de la viande ou si nous craquons une allumette. L'oxyde nitreux N2O est un autre oxydant parfait, qui est utilisé pour augmenter la vitesse de combustion de l'essence dans les moteurs d'automobiles ordinaires.
Le composant solide (c'est-à-dire la substance inflammable) peut être n'importe quoi qui brûle. Le carburant utilisé pour les vols spatiaux doit produire le maximum d'énergie par unité de masse brûlée. Et il doit libérer cette énergie rapidement – les vaisseaux spatiaux nécessitent une poussée puissante. Pourtant, d'un point de vue théorique, même la paraffine ou le polyéthylène peuvent fournir la poussée nécessaire.
Et d'un point de vue pratique ?
« MythBusters » a adopté une approche expérimentale à cette question. Ils ont utilisé de l'oxyde nitreux comme oxydant et, pour leur composé solide inflammable, ils ont choisi… le salami ! Pourquoi ? Le salami est très gras, et le gras est combustible. De plus, le salami contient suffisamment de nitrates (sels d'acide nitrique) qui s'enflamment facilement et même, qui explosent. De nombreux mélanges explosifs contiennent des nitrates.
Inutile de dire que ces expérimentateurs créatifs ont réussi ! Certes, leur parcours de fusée fut court et tortueux, mais elle a quand même décollé !