Pile saline
Fabriquez une véritable pile saline !
Réactifs
Sécurité
- Portez des gants et des lunettes de protection.
- Réalisez l’expérience sur le plateau en plastique.
- Éviter tout contact des produits chimiques avec les yeux ou la bouche.
- Éloigner les jeunes enfants, les animaux et les personnes sans équipement de protection des yeux de la zone où sont réalisées les expériences.
- Ranger ce coffret d’expériences hors de portée des enfants de moins de 10 ans.
- Nettoyer la totalité du matériel après utilisation.
- S’assurer que tous les récipients sont hermétiquement fermés et convenablement stockés après utilisation.
- S’assurer que tous les récipients vides sont correctement éliminés.
- Ne pas utiliser d’autre matériel que celui fourni avec le coffret ou recommandé dans la notice d’utilisation.
- Ne pas remettre les denrées alimentaires dans leur récipient d’origine. Les jeter immédiatement.
- En cas de contact avec les yeux : laver abondamment à l’eau en maintenant les yeux ouverts si nécessaire. Consulter immédiatement un médecin.
- En cas d’ingestion : rincer la bouche abondamment avec de l’eau, boire de l’eau fraîche. Ne pas faire vomir. Consulter immédiatement un médecin.
- En cas d’inhalation : transporter la personne à l’extérieur.
- En cas de contact avec la peau et de brûlures : laver abondamment à l’eau la zone touchée pendant au moins 10 minutes.
- En cas de doute, consulter un médecin sans délai. Emporter le produit chimique et son récipient.
- En cas de blessure, toujours consulter un médecin.
- L’utilisation incorrecte des produits chimiques peut engendrer des blessures et nuire à la santé. Réaliser uniquement les expériences décrites dans les instructions.
- Ce coffret d’expériences est à utiliser uniquement par des enfants de plus do 10 ans.
- Compte tenu de très grandes variations des capacités des enfants, même au sein d’un groupe d’âge, il convient que les adultes surveillants apprécient avec sagesse quelles sont les expériences appropriées et sans risque pour les enfants. Il convient que les instructions permettent aux adultes surveillants d’évaluer chacune des expériences afin de pouvoir déterminer son adéquation à un enfant particulier.
- Il convient que l’adulte surveillant s’entretienne des avertissements et des informations de sécurité avec l’enfant ou les enfants avant de commencer les expériences. Il convient d’accorder une attention particulière à la sécurité lors de la manipulation d’acides, d’alcalis et de liquides inflammables.
- Il convient que la zone où sont réalisées les expériences soit sans obstacle et ne soit pas située près d’une réserve de denrées alimentaires. Il convient qu’elle soit bien éclairée et aérée, et à proximité d’une adduction d’eau. Il convient d’utiliser une table solide dont la surface est résistante à la chaleur.
- Il convient d’utiliser complètement les substances contenues dans des emballages non refermables au cours d’une expérience, c’est-à-dire après l’ouverture de l’emballage.
FAQ et dépannage
Tous ces éléments doivent être bien ajustés à l’intérieur du tube. N’ayez pas peur d’employer plus de force, au besoin. Vous pouvez aussi essayer d’utiliser une autre électrode en graphite ou un autre cylindre de coton. Et, bien sûr, vous pouvez toujours demander l’aide d’un adulte.
Vous pouvez dessiner tout ce que vous voulez – laissez libre cours à votre imagination !
Assurez-vous que le boulon touche la pince métallique du mécanisme d’horloge, et que l’électrode en graphite qui se trouve à l’extrémité opposée de la pile touche la partie métallique du boîtier du mécanisme d’horloge.
Si vous avez assemblé les deux piles et que vous les avez correctement connectées à la LED, mais que la LED ne s’allume pas – ne vous inquiétez pas ! C’est probablement facile à résoudre.
Tout d’abord, essayez de changer les fils. Le courant électrique peut traverser une LED seulement dans une direction. Assurez-vous que les pinces crocodiles sont fixées au métal, et non pas à l’isolant.
Vérifiez ensuite toutes les connexions. Tous les composants du circuit sont-ils correctement connectés ? Le boulon doit toucher les ressorts du connecteur, et les électrodes en graphite aux extrémités opposées des piles doivent toucher les parties métalliques du boîtier du connecteur. Vérifiez enfin que tous les fils sont solidement fixés à la LED et au connecteur.
Si aucune de ces étapes ne vous aide, essayez d’utiliser une autre LED ou d’assembler une nouvelle pile.
Nous ne recommandons pas de connecter des piles ordinaires aux LED fournies dans le coffret. Cela pourrait entraîner une surchauffe ou un dysfonctionnement des LED.
Instructions pas à pas
Mélanger de l'oxyde de manganèse(IV) MnO2 avec du graphite C. MnO2 aura pour effet de « tirer » des électrons du zinc Zn, tandis que le graphite permettra aux électrons de voyager à travers le mélange.
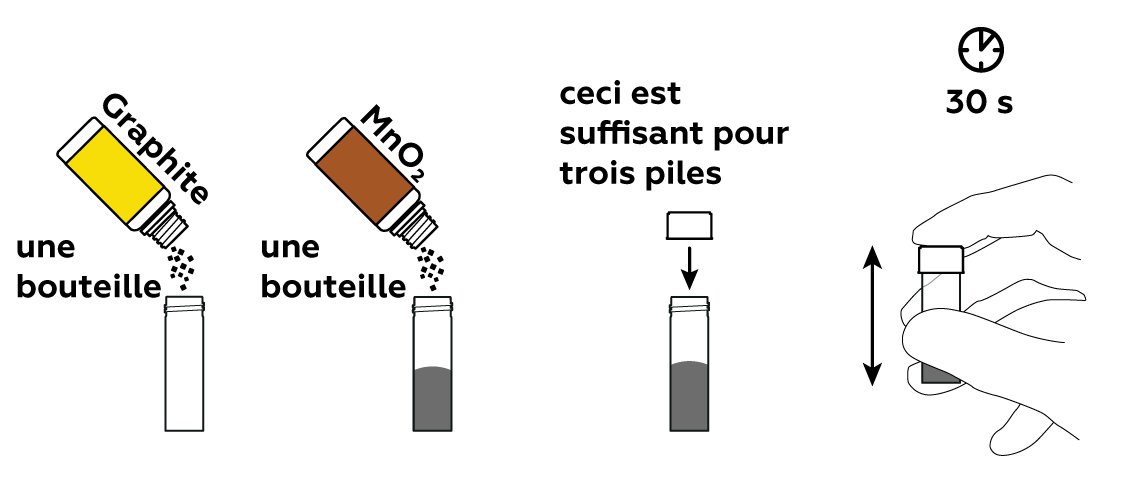
Insérez une électrode en graphite dans un tube en silicone. Ce sera le corps de la pile.
Versez une partie de votre mélange C et MnO2 dans votre cartouche de pile.

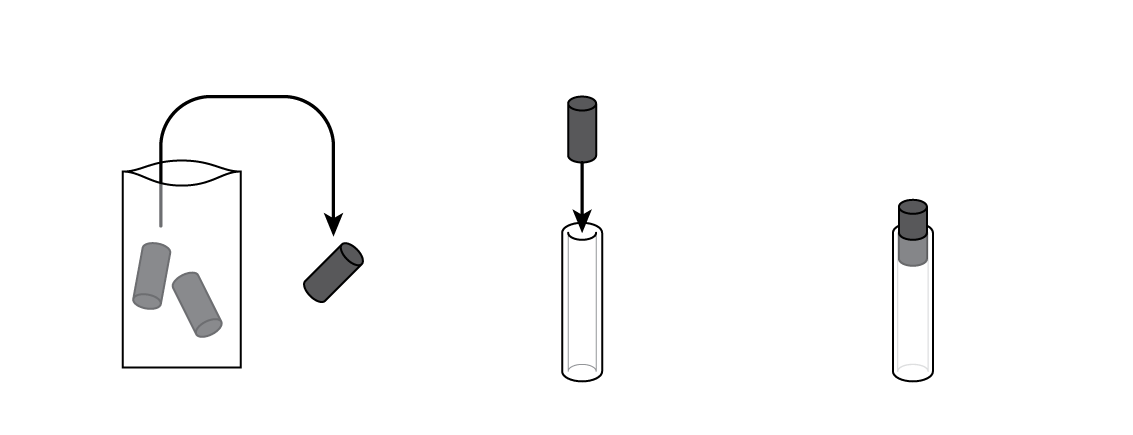
Placez un cylindre de coton dans la cartouche et imbibez-le avec une solution de chlorure d’ammonium NH4Cl. Insérez ensuite un boulon plaqué de zinc Zn : votre pile est prête !

Assemblez l'horloge pour utiliser votre nouvelle pile.

Zn est enclin à donner ses électrons e−. Les électrons sont chargés négativement, c'est pourquoi le côté Zn de la pile est connecté au « − » de l'horloge. MnO2 est prêt à prendre les électrons du zinc et son côté est marqué « + ». Les électrons ne peuvent cependant pas traverser le coton ou la solution de NH4Cl donc ils ont besoin d'une autre route. Contrairement à la solution NH4Cl, le fonctionnement interne de l'horloge laisse passer les électrons. Mais leur passage n'est pas gratuit : en retour, ils font tourner l'horloge. C'est ainsi que fonctionnent tous les appareils électriques.

Assemblez une autre pile et utilisez les deux ensemble pour alimenter une LED.

Élimination des déchets
Veuillez vous reporter aux réglementations locales pour la collecte des déchets chimiques. Jetez les autres déchets solides avec les ordures ménagères. Versez les solutions restantes dans l'évier. Rincez abondamment à l’eau.
Description scientifique
Si les électrons passent du zinc Zn à l'oxyde de manganèse(IV) MnO2, ne peut-on pas tout simplement mettre le fil « + » de l'appareil
dans de la poudre de MnO2
, connecter le fil « − » à un morceau de zinc
, et crier victoire ? Et non, pas si vite...
Dès qu’un électron chargé négativement quitte le zinc Zn , ce dernier devient positif et veut faire revenir l’électron. À moins qu’il n’arrive à se débarrasser de sa charge. C’est à ce moment que le chlorure d’ammonium NH4Cl
dans l’eau H2O
entre en jeu.
Le Zn métallique peut se débarrasser de sa charge en libérant les particules Zn2+
chargées positivement dans la solution. Une réaction semblable se produit avec MnO2
, qui gagne des électrons e−
chargés négativement. Pour se décharger, il donne finalement son oxygène O
à l’eau H2O
, formant OH−
. Les particules Zn2+
et OH−
sont chargées, mais contrairement aux électrons, elles peuvent se déplacer librement dans la solution. Elles vont donc se répandre et se mélanger dans le coton imbibé de NH4Cl, le rendant uniformément non chargé.
Il existe d'innombrables méthodes pour forcer les produits chimiques à déplacer des électrons dans des fils, et celle-ci n'est pas la plus simple. Mais votre pile est chimiquement identique aux piles zinc-carbone vendues dans le commerce. Une combinaison d'ingrédients largement disponibles, l'absence de liquides à écoulement libre dans la construction de la pile et de produits gazeux lors de la réaction expliquent pourquoi ces piles sont si populaires.
Comment les piles salines fonctionnent-elles ?
Cette pile (aussi appelée pile Leclanché ou pile zinc-carbone) est une source chimique de courant électrique qui repose sur une réaction d’oxydoréduction (redox) entre le dioxyde de manganèse (MnO2) et la poudre de zinc (Zn). Une telle réaction implique le transfert d’électrons d’un élément (le réducteur) vers un autre élément (l’oxydant).
Notre pile est divisée en deux parties, séparées par du coton : une partie contient l’oxydant MnO2, et l’autre contient le réducteur Zn. Lorsque la pile n’est pas connectée à quoi que ce soit, ces substances isolées ne peuvent pas réagir entre elles. Mais lorsque les pinces crocodiles sont connectées à une diode, le circuit est fermé et la réaction peut commencer : les électrons commencent à se déplacer de la partie zinc vers la partie manganèse. Ils passent du boulon, à travers les ressorts et le fil noir, à la diode qui commence alors à briller ! Ils continuent ensuite à se déplacer travers le fil rouge, et enfin à travers l’électrode en graphite jusqu’à la partie dioxyde de manganèse (MnO2).
Pourquoi avons-nous besoin de la poudre de graphite ?
La pile fonctionnera seulement si le courant électrique peut circuler « sans obstruction ». Les agents à l’intérieur de la pile doivent donc être capables de très bien conduire l’électricité.
Contrairement au graphite, le dioxyde de manganèse MnO2 n’est pas un bon conducteur. Par contre, un mélange de MnO2 et de poudre de graphite est un bon conducteur pour ce type de pile.
Pourquoi avons-nous besoin de la solution de NH4Cl ?
Lorsque les électrons se déplacent de la partie zinc vers la partie dioxyde de manganèse, ils créent un excès d’électrons dans cette dernière. En même temps, une pénurie d’électrons apparaît dans la partie zinc, lorsque les électrons en sortent. Ceux-ci doivent être équilibrés pour que la pile fonctionne de manière fiable pendant une longue période.
Le chlorure d’ammonium NH4Cl sert principalement de source d'ions hydrogène H+, qui peuvent équilibrer l’excès d’électrons dans la partie dioxyde de manganèse MnO2.
En même temps, les ions chlorure Cl− compensent la pénurie d’électrons dans la partie zinc.
De plus, du côté du zinc, la réaction crée du Zn2+, qui forme facilement des composés insolubles dans ces conditions. Si ces composés s’accumulent, le courant électrique finira par s’arrêter. Une fois de plus, le chlorure d’ammonium vient à la rescousse : l’ammoniac NH3 obtenu lors de la réaction forme avec le Zn2+ un composé facilement soluble dans l’eau.
Ça, c’est intéressant !
De quoi les piles ordinaires sont-elles faites ?
La principale différence entre les piles zinc-carbone et les piles alcalines est le type d’électrolyte contenu dans la pile. Comme nous le savons déjà, les piles salines (ou « piles zinc-carbone ») contiennent du chlorure d’ammonium NH4Cl. Cet agent est un sel, d’où son nom informel de pile saline. Les piles alcalines, quant à elles, contiennent une solution alcaline : des hydroxydes de métaux alcalins (LiOH, NaOH, KOH). Parmi les trois, l’hydroxyde de potassium KOH est celui qui est le plus fréquemment utilisé. Les piles diffèrent également par leur structure. Les piles alcalines fonctionnent généralement plus longtemps que les piles salines.
Les piles salines et alcalines portent des mentions différentes. Le marquage de la pile (quelques lettres ou chiffres sur le boîtier) consiste généralement en une ou deux lettres et chiffres. Les chiffres désignent le type de pile selon sa forme et sa taille. Les piles AA et AAA sont marquées respectivement 03 et 6. Les chiffres sont précédés de lettres ; R pour les piles salines et LR pour les piles alcalines. Par exemple, une pile alcaline AA sera marquée LR03. Les piles au lithium sont désignées par les lettres CR. Si vous avez une pile avec SR ou PR comme deux premières lettres – vous avez de la chance ! Cela signifie que vous détenez une pile rare oxyde d’argent ou zinc-air.
De manière générale, tout appareil nécessitant une alimentation électrique peut fonctionner avec des piles zinc-carbone. Cependant, une petite pile ne suffira pas à alimenter un réfrigérateur ou une machine à laver, par exemple. Les piles zinc-carbone peuvent alimenter de petits gadgets, comme des lampes de poche, des moteurs de petites voitures, des horloges et des montres.La pile saline que nous assemblons peut alimenter une LED, une montre ou une petite calculatrice. Ces petits appareils ne nécessitent que peu d’électricité pour fonctionner de manière fiable.
Habituellement, une pile semblable à celle que nous assemblons fournit suffisamment d’énergie pour faire briller intensément une LED pendant 2 à 3 heures. Si vous faites un effort et l’assemblez avec une extrême précision, une pile comme celle-ci peut fonctionner jusqu’à 10–12 heures !
Chimiquement, notre pile est exactement la même ! La principale différence réside dans la structure générale des piles. Dans une pile zinc-carbone du commerce, les couches oxydantes (MnO2) et réductrices (Zn) sont beaucoup plus minces, mais elles sont larges et la surface de la membrane (dans notre cas, le coton) est beaucoup plus grande. Une telle pile peut produire un courant plus fort que la nôtre – c’est pourquoi elle peut alimenter une plus grande variété d’appareils (lampes de poche puissantes, télécommandes de télévision, jouets pour enfants, souris d’ordinateur). De plus, une telle pile est étanche à l’air et ne laisse pas l’électrolyte (la solution de chlorure d’ammonium NH4Cl) qui se trouve à l’intérieur s’évaporer. Dans notre cas, l’évaporation de la solution d’électrolyte est la principale raison pour laquelle notre pile s’épuise si rapidement.